
H2S
سولفور هیدروژن
هيدروژن سولفوره گازي بيرنگ و شديداً سمي است كه به آساني در آب حل شده و داراي قابليت اشتعال و انفجار است. سولفيد هيدروژن H2S گازي خطرناك و كشنده است كه در غلظتهاي پايين بوي تخممرغ فاسد و در غلظتهاي بالا بوي شيرين دارد.
اين گاز قابل انفجار بوده و چنانچه در غلظتهاي بين 4% تا 44% در هوا، در معرض شعله باز و يا منبع توليد جرقه قرار گيرد باعث ايجاد حريق و انفجار ميشود. شعله آن آبي رنگ است و با افزايش دما و حرارت، شدت اشتعال آن بيشتر ميگردد. به هنگام نشت، چون سنگين تر از هواست، بدون اينكه به سمت بالا حركت كند تا مسافت زيادي پخش شده و در صورت مشتعل شدن خسارات جانی و مالي فراواني بر جاي ميگذارد.
این گاز در نتیجه فرایندهای زیر ایجاد میگردد:
1 تجزیه بقایای انسانی وحیوانی در نتیجه فعالیت های باکتریایی
2 فعالیت های صنعتی نظیر فرآوری مواد غذایی
3 کوره های ذغال سنگی
4 صنایع کاغذ سازی
5 صنایع نساجی
6 تأسیسات تصفیه فاضلاب
7 صنایع تولید گوگرد
8 طرح های تولید قیر و آسفالت
9 صنایع دباغی
SO2
دی اکسید گوگرد
این گاز بی رنگ دارای بوی خفه كننده بوده و از احتراق گوگرد یا مواد شامل گوگرد مثل زغال سنگ یا نفت بوجود می آید. همراه با اكسید نیتروژن از عوامل باران اسیدی در اتمسفر بخصوص در شرایط مه می باشد و مشكلات تنفسی بسیاری برای انسان به وجود می آورد.
در صنعت، حد مجاز ایمنی آن 2 ذره در میلیون است. به وفور در مناطق صنعتی یافت می شود و به عنوان ماده اولیه در فرآیندهای صنعتی بكار می رود. در صنایع آب و فاضلاب، به منظور حذف كار اضافی و در فرآیندهای تولید مواد خوراكی، به جهت خواص ضد عفونی كننده آن كاربرد دارد. از آنجا كه تقریبا دو برابر وزن هوا را دارد، بسرعت به سطوح پایین هوا منتقل می شود.
کاربرد های دی اکسید گوگرد:
·گاز SO2 سابقا به عنوان سرد کننده بکار میرفت.
·به عنوان ضدعفونی کننده
·به عنوان رنگبر در تکنولوژی مواد غذایی
·در صنایع نساجی و کاغذ سازی
·برای تهیه H2SO4 و H2SO3 و NaHSO3
NOX
نیتریک اکسید
شکل ظاهری این ترکیب، گاز بیرنگ است. این ترکیب با فرمول شیمیایی NO یک رادیکال آزاد است و یک مادۀ حدواسط مهم در صنایع شیمیایی به حساب میآید.
نیتریک اکسید یک محصول جانبی است که در اثر سوختن مواد در هوا به تشکیل میشود. مانند آنچه در موتور خودرو و نیروگاههای سوختهای فسیلی تولید میشود. علاوه بر اینها، این ماده به صورت طبیعی در اثر تخلیۀ الکتریکی آذرخشها در طوفانهای تندری تولید میشود.
CO
مونوکسید کربن
تمامی وسایل و دستگاههایی که وظیفه سوزاندن چیزی را به عهده دارند (مانند یک بخاری گازی یا نفتی، یک آبگرمکن یا حتی موتور یک خودرو) تا حدودی مونواکسیدکربن تولید میکنند، میزان این تولید به شرایط احتراق (سوختن) بستگی دارد؛ هرچه میزان اکسیژن در هنگام سوختن کمتر باشد بخش بیشتری از کربنها دچار ناقص سوزی میشوند و به جای دیاکسید کربن (CO۲) مونواکسیدکربن (CO) تولید میکنند.
افرادی که در یک فضای سربسته در معرض استنشاق این گاز قرار میگیرند ابتدا احساس کرختی و خواب آلودگی میکنند و در صورتی که هرچه سریعتر مکان را ترک نکنند یا هوای تازه تنفس نکنند دچار بیهوشی و در نهایت خفگی میشوند.
گازی است که بر اثر سوختن ناقص کربن به وجود میآید. این گاز بسیار سمی است اما رنگ و بوی خاصی ندارد. به همین دلیل کربن مونوکسید قاتل نامرئی نامیده میشود.
CO2
دیاکسید کربن
یا گازکربنیک (با فرمول شیمیایی CO۲)، از ترکیب کربُن با اکسیژن به دست میآید. گاز کربنیک بر اثر سوختن زغال و مواد آلی در مجاورت اکسیژن، تخمیر مایعات، تنفس جانوران و گیاهان و غیره به دست میآید.
گاز دیاکسید کربن گازی است بیرنگ، بیبو، دارای طعمی مایل به اسید است.
در صورت تنفس این گاز انسان ابتدا احساس تنگی نفس کرده و پس از مدت بسیار طولانی ممکن است خفه شود. دیاکسید کربن برخلاف اکسیژن که باعث شعلهور تر شدن آتش میشود، باعث خفگی آتش میشود، به همین خاطر است که در کپسولهای آتشنشانی گاز دیاکسید کربن وجود دارد.
دیاکسید کربن مهمترین گازهای گلخانهای طولانی مدت در جو زمین است.
NO2
دیاکسید نیتروژن
از مهمترین آلایندههای هوا به شمار می رود. هر سال میلیونها تن از این گاز در اثر فعالیتهای انسانی به ویژه مصرف سوختهای فسیلی تولید میشود. دیاکسید نیتروژن در ترکیب با هوای مرطوب تولید اسید نیتریک میکند که موجب پوسیدگی شدید فلزات میشود.
همچنین در غلظتهای بالا باعث ایجاد مهدود شده و میدان دید را به شدت کاهش میدهد و بر رشد گیاهان اثر منفی شدید دارد. این گاز از اثر گلخانهای نیز برخوردار است.


NH3
آمونیاک (به انگلیسی: Ammonia) با فرمول شیمیایی NH3، ترکیبی از نیتروژن و هیدروژن است.
آمونیاک مهمترین ترکیب هیدروژنه ازت است و در طبیعت از تجزیه مواد آلی ازت دار بدست میآید. آمونیاک گازی است بی رنگ، با مزه فوق العاده تند و زننده که اشکآور و خفه کننده است. گاز آمونیاک از هوا سبک تر بوده و به سهولت به مایع تبدیل میشود.
آمونیاک درآب بسیار محلول بوده و در منفی ۷۷/۷ درجه سانتیگراد منجمد و در منفی ۳۳/۳۴ درجه سانتیگراد به جوش در میآید. وزن مخصوص محلول اشباع آمونیاک ۰/۸۸ گرم بر سانتیمتر مکعب است. گاز آمونیاکقابل افروزش و حدود اشتعالش ۱۶-۲۵ درصد حجمی گاز آمونیاک در هوا است.
آمونیاک در کارخانجات یخ سازی، در ساخت کودهایی از قبیل نیترات، سولفات و فسفات آمونیوم، تهیه اسید نیتریک، دارو و مواد منفجره بکار میرود.
HF
هیدروژن فلورید با فرمول Hydrogen fluoride) HF) یک ترکیب شیمیایی گازیِ سبکتر از هواست.
این ترکیب در دمای کمی کمتر از دمای معمولی اتاق (همانند بسیاری از هیدروژن هالیدها) در ۱۹.۵ درجه سانتیگراد میجوشد و در دمای پایینتر از -۸۴ درجه سانتیگراد به صورت جامد در میآید. این ترکیب از منابع اصلی فلوئور است، با حل شدن در آب هیدروفلوریک اسید را به وجود میآورد که اثرات خورندگی بسیاری دارد و در صنایع پتروشیمی کاربرد زیادی دارد. این ماده بسیار سمی بوده و میتواند به ریهها آسیب بزند.

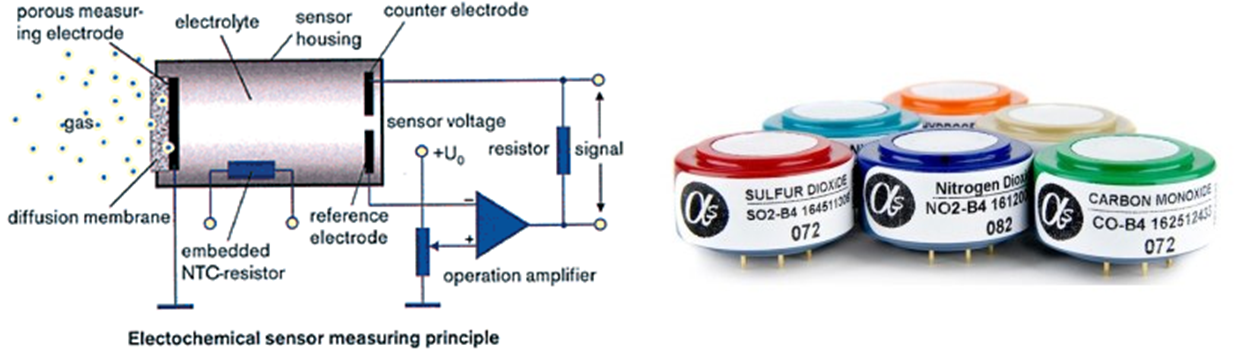
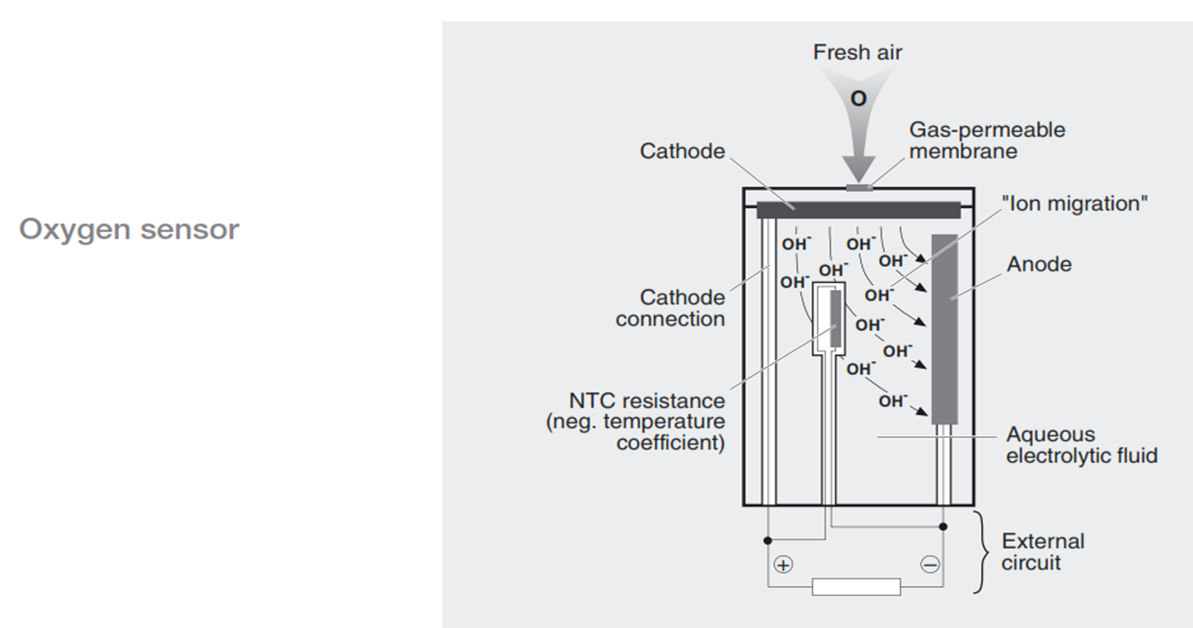
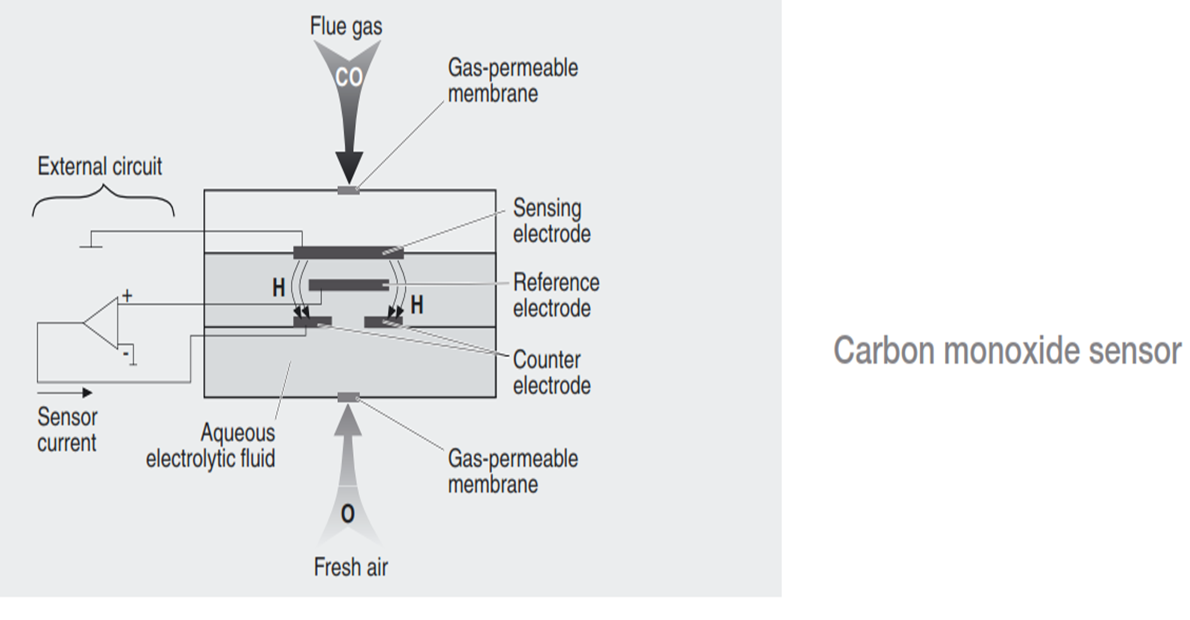
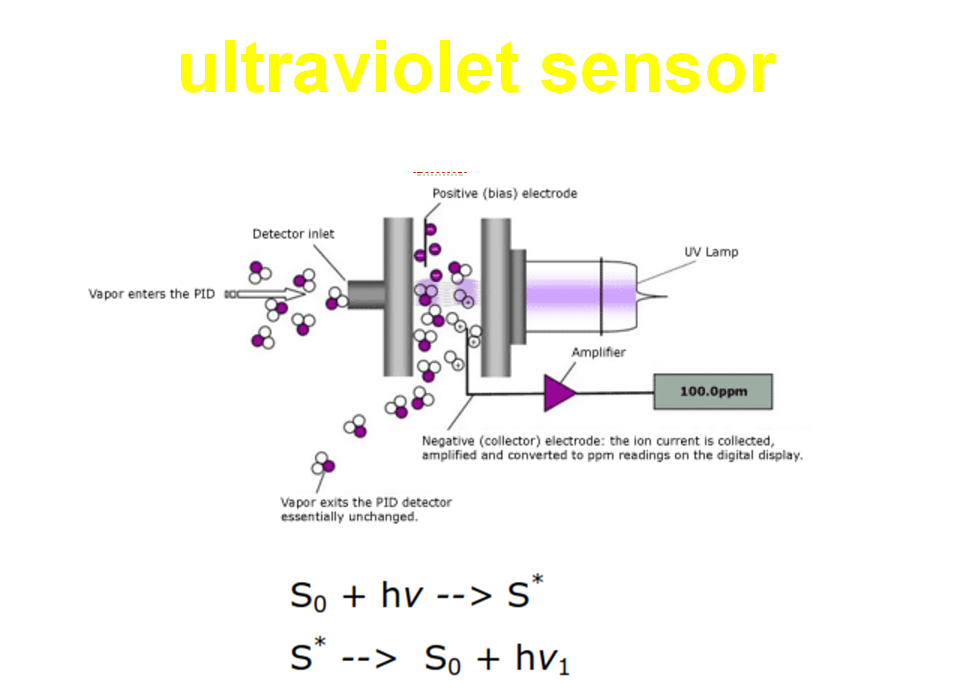
electrochemical sensor
در اين روش گاز در برخورد با يک الکترود که درون يک محلول الکتروليت قرار دارد، اکسايش يا کاهش می يابد يون ها يا الکترون های آزاد شده در محلول توسط يک الکترود ديگر جمع آوری مـی شـود جريان الکتريکی توليد می کند. با اندازه گيری اين جريان می توان مقدار گاز را اندازه گيری نمود.
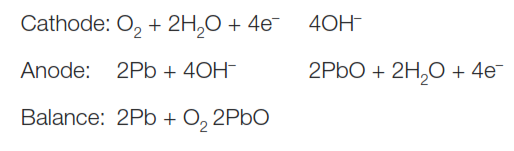
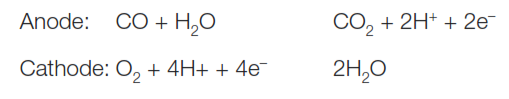
Infrared sensor
تابش مادون قرمز توسط گازها جذب میشود که هر گاز طول موج جذب خاص خودش را دارد. هنگام عبور تابش مادون قرمز از درون سلولی که با گاز پر شده است، مقداری تابش جذب گاز میشود. هرچه غلضت گاز بیشتر باشد مقدار جذب بیشتر و در نتیجه با توجه به مقدار تابش دریافتی توسط سنسور میتوان به مقدار غلضت پی برد.
برای تشخیص اینکه این تابش توسط کدام گاز جذب شده است (در مخلوطی از چند گاز) 2 روش وجود دارد:
1.Dispersive principle
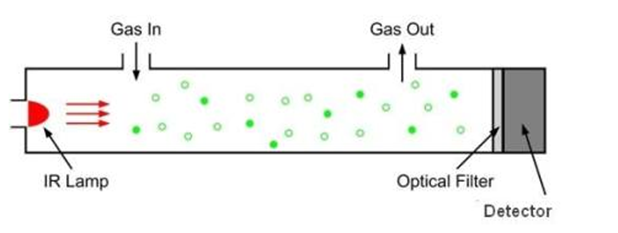
2.Non dispersive principle

قانون بير:
در صورتی که يک پرتو مادون قرمز با طول موج خاص به گاز تابانده شود مولکول های گاز تحريک شده مقداری از انرژی پرتو تابيده شده را جذب می کنند. هرچه تراکم گاز مور نظر بيشتر شد انرژی جذب شده نيز بيشتر خواهد بود.


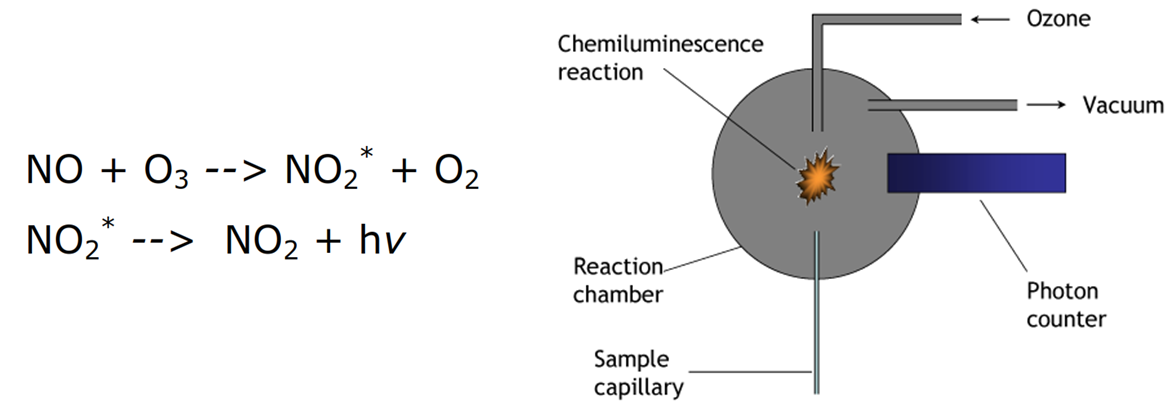
chemiluminescence detector (CLD)
این روش برای اندازه گیری غلضت های پایین نیتروژن اکسید و نیتروژن دی اکسید به کار میرود. بر پایه تاثیر گاز نیتروژن اکسید در واکنش با اوزون می باشد که نتیجه آن در تغیییر شدت نور تابیده حاصل از این واکنش می باشد.
شدت نور تابیده به غلضت نیتروژن اکسید مربوط میباشد. استفاده از این روش برای اندازهگیری گاز حاصل از اگزوز خودروها بسیار رایج می باشد.
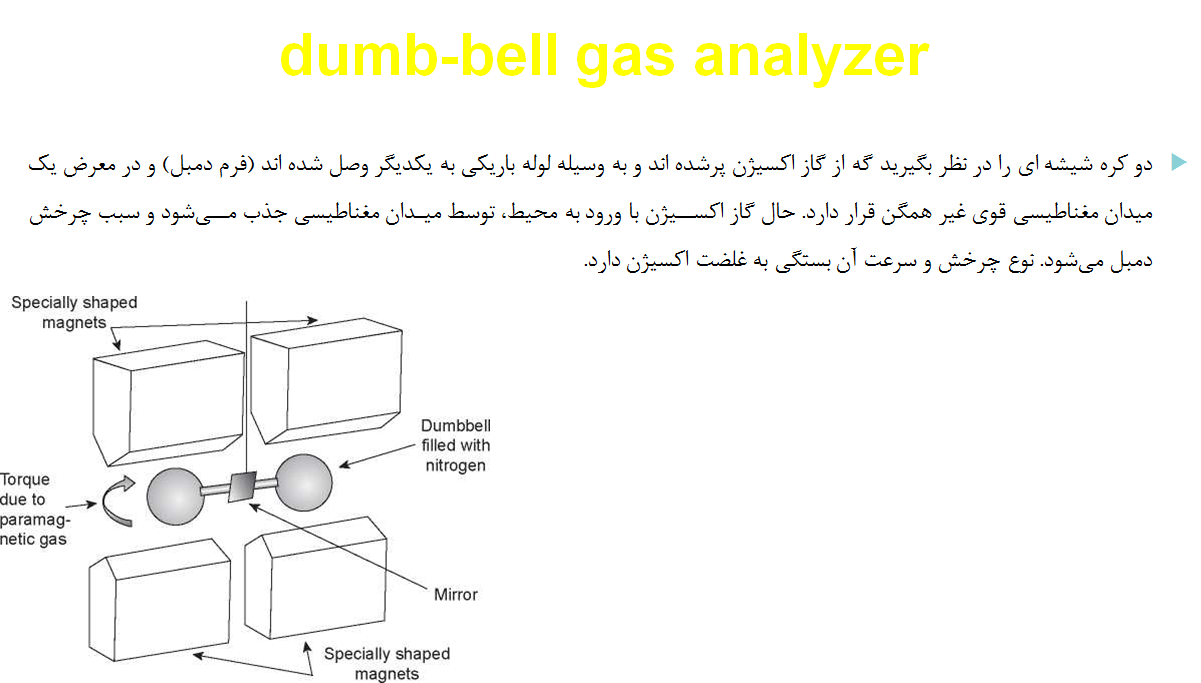
Paramagnetic method
این روش فقط برای آنالیز گاز اکسیژن می باشد. اکسیژن تنها گازی است که خاصیت بالایی از پارامغناطیس دارد و مولکولهای اکسیژن جذب میدان مغناطیسی می شوند.
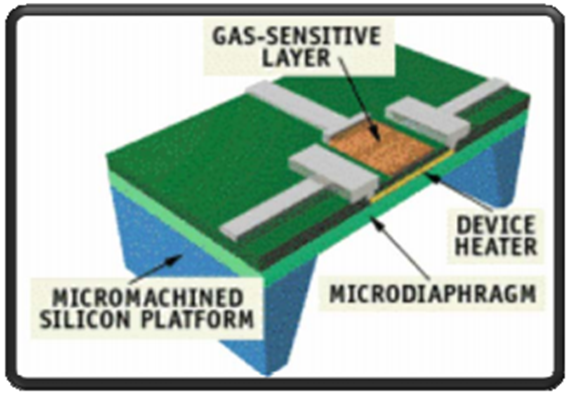
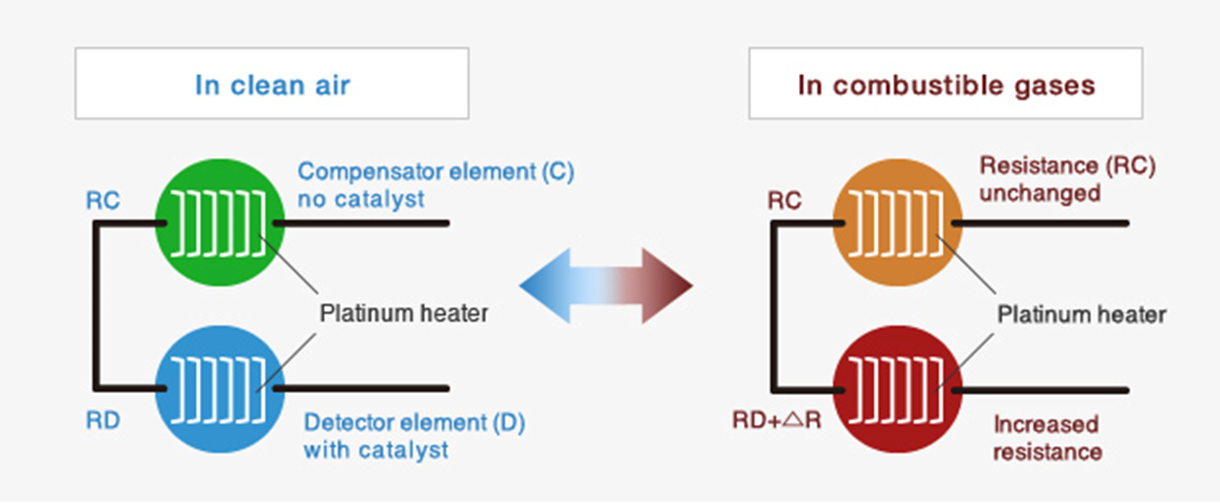
metal oxide semiconductor
در اين روش گاز مورد نظر در برخورد با يک نيمه هادی اکسيد فلزی موجب تغيير هدايت الکتريکی آن می شود که با اندازه گيری ميزان تغيير هدايت الکتريکی می توان غلظت گاز را اندازه گيری نمود.

در چه جاهایی آلایندهها را اندازه میگیریم؟
اندازه گيری ميزان آلودگی هوا و آلودگی های توليدی توسط واحدهای صنعتی
اندازه گيری گازهای سمی و ميزان کمبود اکسيژن در فضاهای کاری محبوس
اندازه گيری گازهای قابل اشتعال در پالايشگاه ها و سازه های پتروشيمی
اندازه گيری اکسيژن گازهای قابل اشتعال در آتش نشانی
اندازه گيری ميزان گازهای سمی در برخی صنايع برای حفاظت و سلامت پرسنل
اندازه گيری نسبت هوا به سوخت در موتورهای بنزينی گازسوز
شرکت خدمات مهندسی جنوب محصولات متنوعی جهت اندازهگیری آلایندههای هوا و محیط ارائه می نمایید.
جهت کسب اطلاعات بیشتر با کارشناسان ما تماس بگیرید.
فایل کامل مطلب فوق را از لینک زیر بصورت پاورپوینت می توانید دانلود نمایید.


دیدگاه خود را بنویسید